肠道菌群与宿主密切合作,影响机体的生理调节,特别是在大脑发育和功能调节,以及孤独症、焦虑症、抑郁症等疾病中发挥关键作用。
临床研究表明,约四分之三的孤独症患者还伴有某些胃肠功能紊乱。这一现象促使科学家们探索肠道微生物与孤独症之间的潜在联系。最近的研究表明,孤独症患者的肠道菌群与对照组有明显不同,但微生物如何影响孤独症仍是一个谜。来自加州理工学院的Sarkis Mazmanian团队筛选了一种可能介导肠道菌群和孤独症的代谢物-4-乙基苯基硫酸盐(4EPS)。酪氨酸可以被肠道微生物群代谢为4EP,然后在宿主磺基转移酶(SULT1A1)的作用下转化为4EPS。4EPS进入小鼠大脑,影响特定脑区的激活和连接,并破坏大脑中少突胶质细胞的成熟和髓鞘化模式,从而调节小鼠的大脑活动和焦虑样行为。相关成果发表在《Nature》上。

1、4 EPS生物合成途径的研究
以前的研究发现,在非典型神经发育的小鼠模型中,代谢物4EPS的相对丰度很高,并且在测试中,4EPS可以改变年轻小鼠的行为。4EPS在孤独症谱系障碍(ASD)患者的血浆中也增加,并且在CNTNAP2小鼠ASD模型中4EPS的变化是一致的。由于4EPS在无菌(GF)小鼠中检测不到,因此推测肠道微生物组中的基因可以将酪氨酸转化为4EP,然后被宿主硫酸化为4EPS(图1a)。
研究表明,厚壁菌门中的一些稀有细菌可以利用对香豆酸(p—coumaric acid)产生4EP,而对香豆酸的前体包括酪氨酸和一些植物基分子。事实上,4EPS可以在以富含酪氨酸的鱼类饮食和大豆饮食为基础的小鼠中检测到。通过筛选候选肠道细菌,研究人员发现卵形拟杆菌(B. ovatus)可以将酪氨酸转化为香豆酸。使用BLAST工具在卵形拟杆菌中鉴定出一个关键酶——酪氨酸解氨酶(BACOVA_01194)。这种酶的缺失将导致B. ovatus失去产生对香豆酸的能力(图1b)。
研究人员用卵形拟杆菌和植物乳杆菌(可将香豆酸转化为4EP)共同定植于GF小鼠,在小鼠尿液中只能检测到低水平的4EPS。为了提高4EPS水平,对该菌株进行了工程化处理。改良的卵形拟杆菌菌株B.ovatus1194/PAD(MFA05)能将酪氨酸转化为中间产物4-乙烯基苯酚,与L.plantarum在植物共培养条件下,4-vinylphenol代谢生成4EP。与此相反,卵形拟杆菌Δ1194突变体(M FA 01)与L.plantarum共培养时,不产生4 EP(图1c和1d)
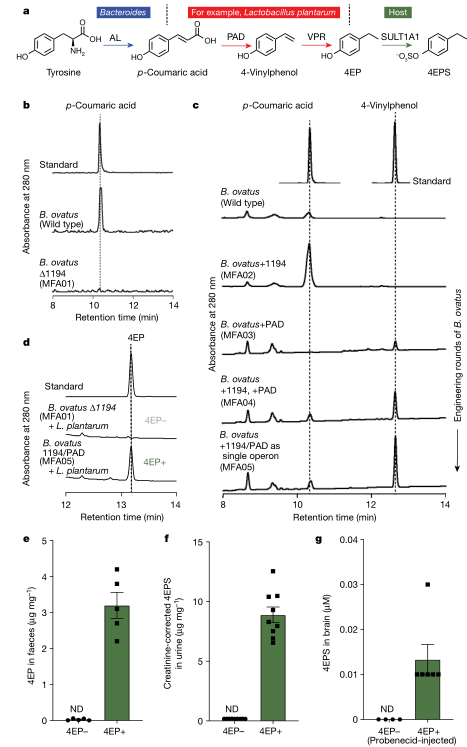
图1、4EPS生物合成途径及菌种基因工程改造
2、菌种定植小鼠4EPS的研究
研究人员分别用B.ovatus 1194/PA D和B.ovatusΔ1194菌株定植GF小鼠,获得了4 EP+和4 EP-小鼠。与预期结果一致,在4EP+小鼠的粪便中可以检测到4EP(图1e),并且在它们的血清和尿液中检测到4EPS(图1f)。用丙磺舒治疗4EP+小鼠后,可在其脑中检测到4EPS,表明4EPS可在脑中蓄积(图1g)。4EP和4EPS是酚类分子,可能具有毒性或炎症特性。然而,4EP+和4EP-小鼠在体重或自由活动方面没有显著差异,细菌定植水平也相似。同时,4EP+小鼠在结肠组织和血清中没有出现肠道功能障碍和促炎反应。在4EP+小鼠的大脑中的细胞因子往往是抗炎,并且没有小胶质细胞活化的功能。研究人员建立了一个简化的动物模型,再现了肠道微生物代谢物暴露与行为变化相关的自然途径。
3、4 EPS对脑活动的影响及机制研究
4EP(S)可能影响多种器官,本研究主要针对脑组织。利用功能超声成像技术评价4EP+和4EP-小鼠全脑功能连接的差异:与4EP-小鼠相比,4EP+小鼠的信号传导模式发生了改变,主要集中在海马、丘脑、杏仁核、下丘脑和梨状体和皮层,提示4EPS升高与小鼠脑各区域之间的功能联系异常有关。随后的葡萄糖摄取实验比较了大脑中的神经活动:4EP(S)与下丘脑亚区、杏仁核和终纹,床核,还有丘脑室旁核的葡萄糖摄取有关系。这都表明了4EP(S)会引起多个脑区功能连接和活动的改变,包括与边缘系统相关的几个区域。
为了探讨4EP(S)影响脑活动的分子机制,作者在4EP+和4EP-小鼠的6个脑区(PVT、基底外侧杏仁核、下丘脑、BNST、内侧前额叶皮质和腹侧海马)进行了实验。对mRNA 测序分析。结果表明,4EP(S)主要影响PVT基因的表达,对BNST和基底外侧杏仁核的影响较小。与4EP-小鼠相比,4EP+小鼠的PVT中神经元、新形成的少突胶质细胞和成熟少突胶质细胞特异性基因的表达减少,表明这些细胞类型的发育、丰富和/或活性的下降与4EP(S)相关。进一步分析发现,在4EP+小鼠中,未成熟少突胶质前体细胞增加,成熟少突胶质细胞减少,泛神经元标记物NeuN和泛少突胶质细胞标记物OLIG2的水平保持不变。表明,4EP(S)影响少突胶质细胞成熟,而不是在这个谱系内的细胞总数的变化。与此同时,研究人员发现,4EP+小鼠的整个大脑和胼胝体的神经元髓鞘减少。
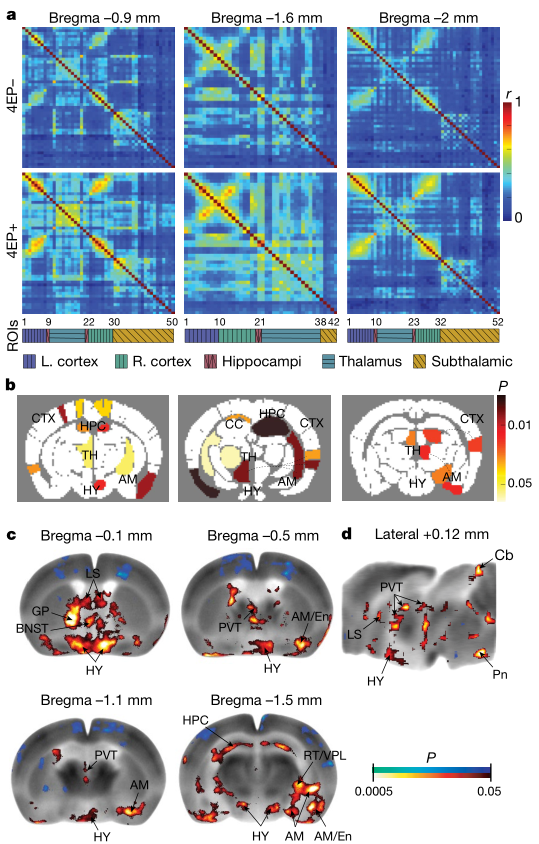
图2、4 EP定植生产4EP对小鼠全脑功能连接和区域激活的影响
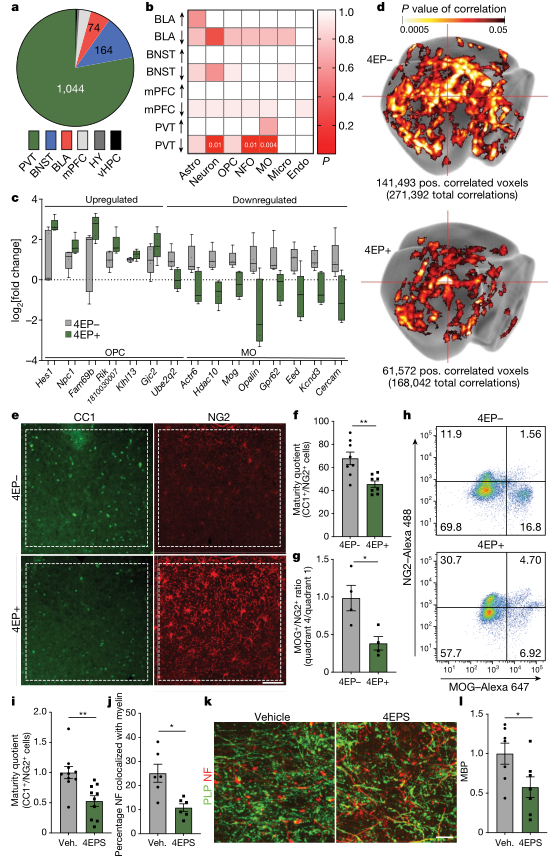
图3、4EP+小鼠脑内少突胶质细胞成熟度降低
4、4EP(S)可诱发焦虑样行为
研究人员探讨了肠道4EP(S)的产生是否可以调节小鼠的行为。数据显示,在几种常见的行为学测试中,4EP(S)可促进明显的焦虑样行为:(1)高架加迷宫,4EP+小鼠在开放臂末端停留的时间更短。(2)在野外野外考察中,4EP+小鼠进入暴露区的时间较少。(3) 在黑白盒子实验中,4EP+小鼠在黑暗中停留的时间更长。4EP+小鼠也表现出增加掩埋行为,反映了焦虑和/或刻板行为的特点。值得注意的是,富马酸氯马斯汀可以促进少突胶质细胞成熟,防止4EP+小鼠的行为改变。咪康唑诱导髓鞘形成也可以改善4EP+小鼠的焦虑样行为,表明4EP(S)通过影响少突胶质细胞成熟来调节小鼠的焦虑样行为。
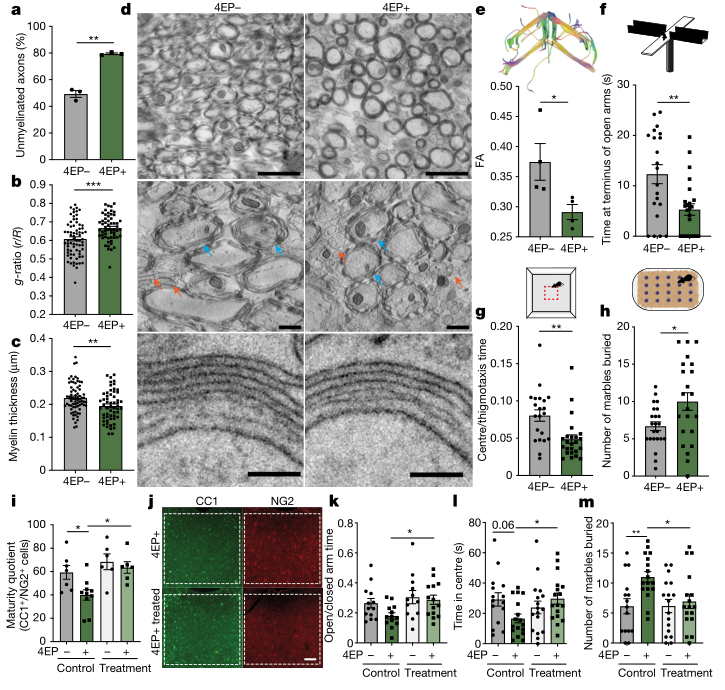
图4、4EP(S) 改变髓鞘形成,诱发类似焦虑的行为
总结
本文研究人员发现了代谢物4EP(S)的生物合成途径。酪氨酸或其他食物来源可作为前体被肠道菌群代谢成4EP;4EP在宿主磺基转移酶的作用下转化为4EPS,然后进入大脑,改变特定大脑区域的激活和连接,破坏大脑中少突胶质细胞的成熟和髓鞘化模式。肠道暴露于4EP诱导小鼠的各种情绪行为。4EP(S)如何导致少突胶质细胞成熟和髓鞘化的变化,以及如何影响行为有待进一步阐明。
参考文献
A gut-derived metabolite alters brain activity and anxiety behaviour in mice. Nature. 2022